Mikrobiologie
Neben allgemeinen Hinweisen zu Material, Untersuchungsauftrag und Bewertung finden Sie hier die Möglichkeit, alle relevanten Informationen zu einem gewünschten Entnahmematerial zu erhalten. Wählen Sie dazu bitte das entsprechende Material im Suchfeld aus.
Allgemeine Hinweise
Material
Untersuchungsmaterial zum Erregernachweis soll möglichst gezielt vom Infektionsort und möglichst ohne Kontamination entnommen werden. Diagnostisch ideal ist solches Material, das direkt aus physiologischerweise sterilen Körperbereichen (ohne Kontakt mit besiedelten Nachbarregionen) gewonnen werden kann. Die Entnahme soll möglichst vor dem Beginn einer Antibiotika-Therapie erfolgen. Mehrmalige Entnahmen erhöhen die diagnostische Sicherheit.
Untersuchungsauftrag
Allgemeiner Untersuchungsauftrag: "Erreger und Resistenz" ("E+R") oder "Bakterien (evtl. Pilze) und Antibiogramm". Die Probe wird dann mittels Mikroskopie (sofern geeignetes Material) und Kultur, bei Wachstum (fakultativ) pathogener Bakterien einschl. Keimdifferenzierung und Antibiogramm, untersucht.
Ausdrücklich anzufordernde spezielle Untersuchungen: auf Aktinomyzeten, A-Streptokokken, Chlamydien, Choleravibrionen, Diphtheriebakterien, Gonokokken, Helicobacter, Legionellen, Mykoplasmen, Pertussisbakterien, Pilze (Hefen, Schimmelpilze, Dermatophyten), Pneumocystis, Protozoen, Tuberkulose- bzw. Mykobakterien, alle viralen Erreger, Wurmeier und Würmer.
Neben der konventionellen Mikrobiologie einsetzbare Nachweisverfahren wie z. B. die PCR (Polymerase-Kettenreaktion zum Nachweis erregerspezifischer DNA) bedürfen der ausdrücklichen Anforderung. Siehe auch "Anforderungshilfe Molekularbiologie" und "Analysenübersicht alphabetisch".
Anamnestische oder klinische Besonderheiten, die den Verdacht auf besondere, bei uns seltene Infektionen lenken, sollten auf dem Begleitschein vermerkt werden (z. B. Auslands-aufenthalt, berufliche Exposition, Kontakt mit Ausscheidern, Tierkontakt). Wichtig sind auch Angaben über eine bereits eingeleitete oder zuvor durchgeführte Chemotherapie.
Bewertung
Die Mikroskopie erfasst nur Keime, die in großer Zahl (über 104/ml) vorliegen und erlaubt meist nur eine vororientierende Keimdifferenzierung, kann aber zusammen mit dem Leukozytenbefund oft schon diagnostische und therapeutische Hinweise geben.
Die Kultur, mit verschiedenen Nährmedien parallel angelegt, erfasst auch kleine Keimmengen. Beim Nachweis fakultativ pathogener Keime in potenziell kontaminierten Materialien muss die Erregernatur nach den jeweiligen Begleitumständen beurteilt werden: mikroskopischer Befund (Leukozyten u. a.), Mono- oder Mischkultur nachgewiesener Keime, wiederholte Nachweisbarkeit, Normalflora im Infektions- und Nachbarbereich, klinischer Befund, Störungen der Infektionsabwehr, ggf. auch Antikörpernachweis im Serum.
Antibiogramm
Allgemeine Hinweise
Eine sinnvolle, gezielte und wirtschaftliche Antibiotikatherapie setzt in der Regel eine Empfindlichkeitsprüfung der kulturell nachgewiesenen Erreger voraus. Neben primären Resistenzen gegen bestimmte Antibiotika tragen die Erreger häufig auch Resistenzen, die sie unter Therapie erworben haben, so dass unter Umständen wiederholte Bestimmungen des Antibiogramms notwendig werden.
Empfindlichkeitsprüfungen sind erforderlich bei Infektionen mit Staphylokokken, Enterokokken, Enterobakterien, Pseudomonaden und anderen Nonfermentern sowie bei Mykobakterien, Neisserien (z. B. Meningokokken) und Anaerobiern. Besonders wichtig sind diese Prüfungen bei Sepsis, Meningitis, Endokarditis und Osteomyelitis, bei nosokomial erworbenen und chronischen Infektionen, bei Erregerwechsel unter der Therapie sowie bei ausbleibendem Therapieerfolg.
Methoden und Beurteilung
Wesentlich verlässlichere Ergebnisse als der weit verbreitete Blättchen-Diffusionstest liefert der quantitative Mikrodilutionstest als Breakpoint-Methode. Das Verfahren prüft das Keimwachstum bei definierten, klinisch relevanten Konzentrationen der einzelnen Antibiotika. Es basiert auf der Bestimmung der minimalen Hemmkonzentration (MHK), d. h. der Antibiotikum-Konzentration, die in vitro eben ausreicht, um das Bakterienwachstum zu hemmen.
Zur klinischen Interpretation wird die ermittelte MHK dem mikrobiologischen Wirkprofil, der Kinetik, Toxikologie und klinischen Wirksamkeit des Antibiotikums gegenübergestellt. Daraus ergibt sich die Eingruppierung in Empfindlichkeitsbereiche (nach DIN 58940):
| S – Sensibel bei Standardexposition: Ein Mikroorganismus wird als Sensibel bei Standardexposition* eingestuft, wenn eine hohe Wahrscheinlichkeit für einen therapeutischen Erfolg bei Standarddosierung der Substanz besteht |
| I – Sensibel bei erhöhter Exposition: Ein Mikroorganismus wird als Sensibel bei erhöhter Exposition* kategorisiert, wenn bei erhöhter Exposition des Infektionserregers gegenüber der Substanz eine hohe Wahrscheinlichkeit für einen therapeutischen Erfolg besteht, z.B. durch Erhöhung der Dosierung/geänderte Verabreichungsform oder durch Konzentrierung am Infektionsort. |
| R – Resistent: Ein Mikroorganismus wird als Resistent eingestuft, wenn auch bei erhöhter Exposition eine hohe Wahrscheinlichkeit für ein therapeutisches Versagen besteht. |
| *Die Exposition des Infektionserregers gegenüber der antimikrobiellen Substanz am Infektionsort ist abhängig von zahlreichen Faktoren, wie der Verabreichungsform, Dosierung, Dosierungshäufigkeit, Infusionsdauer sowie Verteilung und Ausscheidung des Arzneistoffes. |
Die von uns erstellten Antibiogramme werden nach den genannten Grenzkonzentrationen (Breakpoints) schriftlich interpretiert. Die Antibiogramme werden EDV-gestützt auf ihre Plausibilität überprüft und fachärztlich validiert. Die Auswahl der zu testenden Wirkstoffe treffen wir nach der Art des Untersuchungsmaterials und des Erregers, wobei die speziellen Kreuzresistenzen berücksichtigt werden. Wenn vom Einsender die therapeutisch eingesetzten Antibiotika (wünschenswerterweise) angegeben werden, werden diese in die Testung einbezogen oder gesondert kommentiert.
Kreuzresistenz (Parallelresistenz)
Das Vorliegen bestimmter Resistenzen lässt mit hoher Wahrscheinlichkeit darauf schließen, dass parallel auch eine Resistenz gegen andere, meist chemisch verwandte Wirkstoffe besteht. Obwohl Ausnahmen von solchen Regeln bei bestimmten Keimarten vorkommen, ergibt sich für die Praxis des Antibiogramms, dass bestimmte Testergebnisse auf andere Wirkstoffe übertragen werden können. Die wichtigsten dieser "Antibiotika-Klassen" sind in der folgenden Tabelle zusammengestellt:
| Antibiotika-Klasse | Testsubstanz | Ergebnis gilt meist auch für |
|---|---|---|
| Penicilline | Penicillin G | Penicillin V, Azidocillin, Propicillin |
| Aminopenicilline | Ampicillin | Amoxicillin, Pivampicillin, Bacampicillin |
| Penicillinase-feste Penicilline | Oxacillin | Flucloxacillin |
| Acylureidopenicilline | Mezlocillin | Piperacillin* |
| Cephalosporine | Cefaclor |
Cefadroxil u. a. Cefotiam Ceftriaxon, Ceftazidim*, Cefepim* u. a. |
| Aminoglykoside | Gentamicin | Tobramycin* |
| Tetracyline | Doxycyclin | Tetracyclin, Minocyclin |
| Gyrasehemmer | Ciprofloxacin | Levofloxacin** |
* bei Pseudomonas aeruginosa z.T. besser wirksam als die betreffende Testsubstanz
** nicht bei Pseudomonas aeruginosa
Antibiogramm und Antibiotikum-Wahl
Die in-vitro-Befunde "sensibel" und "resistent" lassen nicht sicher auf die klinische Wirksamkeit des Antibiotikums schließen, da diese auch von der körpereigenen Abwehr, Infektionslokalisation u. a. Faktoren abhängt. Das Antibiogramm kann in der Regel nicht sagen, welches Antibiotikum das "beste" ist, sondern nur, welche Substanzen vermutlich nicht wirken.
Unter den Wirkstoffen, gegen die im Antibiogramm Sensibilität besteht, ist die Wahl des optimalen Präparates vor allem nach folgenden Kriterien zu treffen: therapeutische Wirkung (Bakteriostase/Bakterizidie, Pharmakokinetik, Wirkungsspektrum), Nebenwirkungen (Toxizität, Allergien, Normalflora-Zerstörung), klinische Bewährung, Wirtschaftlichkeit sowie unproblematische Anwendung (Applikationsform).
Antibiotika-Kombinationen sind manchmal für ein erweitertes Wirkungsspektrum bei Mischinfektionen, auch bei schweren Monoinfektionen zur Erzielung synergistischer Effekte erforderlich. Bei Kombinationstherapie muss immer auch die Möglichkeit antagonistischer und gleichgerichteter toxischer Effekte beachtet werden.
Diskrepanzen zwischen Antibiogramm und klinischem Verlauf
Sensibler Erreger - klinisch dennoch Misserfolg:
- Abwehrschwäche, besonders Granulozytopenie
- Fremdkörper (Katheter, Implantate)
- nicht drainierter Abszess
- fehlende Bakterizidie
- gestörte Resorption des Antibiotikums
- Antagonismus durch Kombination
- Resistenzentwicklung unter Therapie
- "Erreger" war nicht Erreger, sondern Kontaminant
Resistenter Erreger - klinisch dennoch Erfolg:
- besonders gut zugängliches Kompartiment, z. B. Harnwege
- Spontanheilung, z. B. bei Harnwegsinfekten
- "Erreger" war nicht Erreger, sondern Kontaminant
Information Entnahmematerial
Unten finden Sie die Informationen zu dem entsprechenden Entnahmematerial.
Abstrich (Mikrobiologische Untersuchungen)
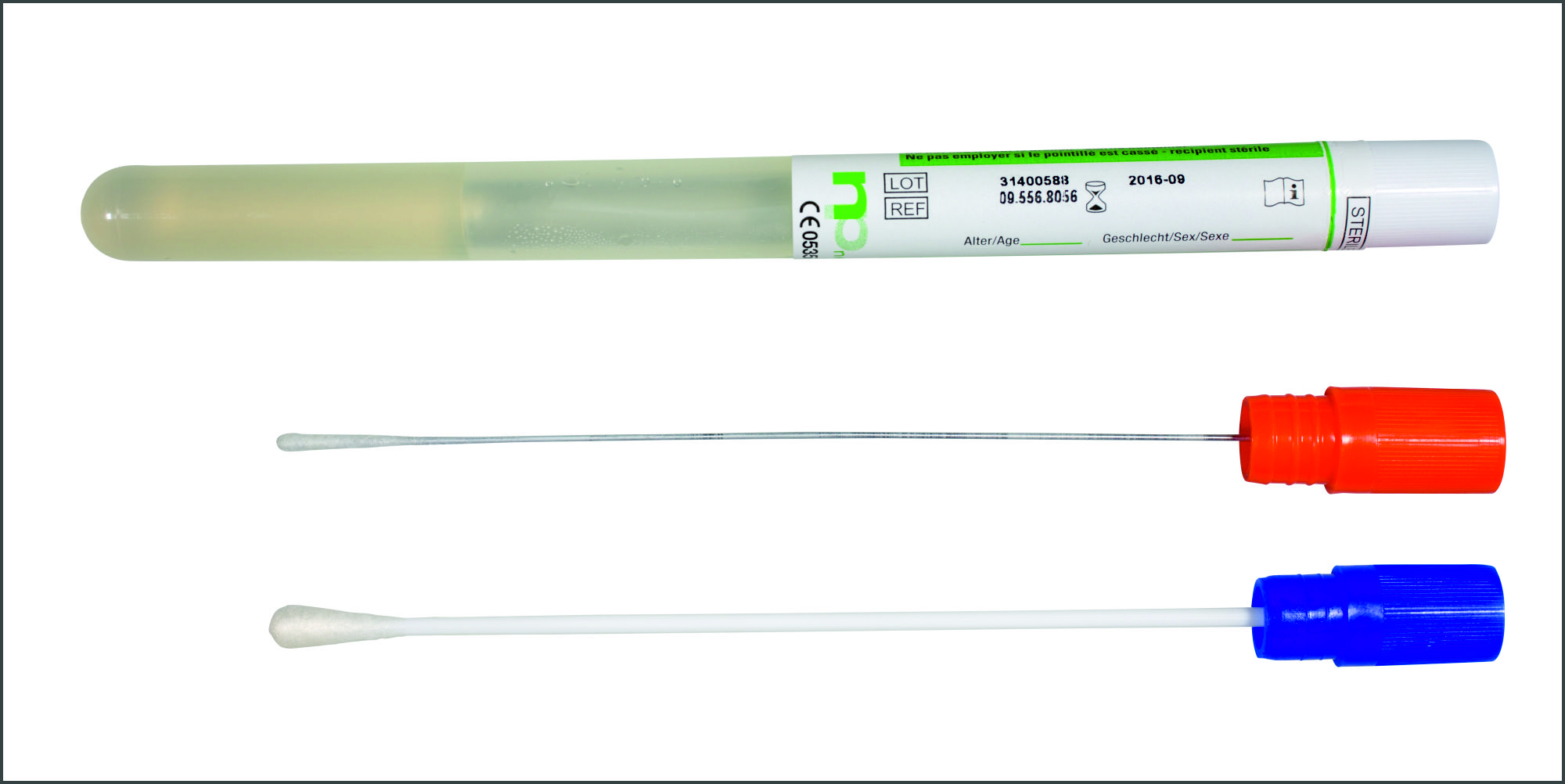
| Bezeichnung | Abstrichtupfer mit Transport-Gel Nicht für freie Sekretflüssigkeit! - dick |
| Anwendungsgebiet |
Augen, HNO, Genitalien², Harnröhre, Wunden |
| Anforderung (Beispiel) |
Erreger & Resistenzen (E + R) |
2 Reichlich gewonnenes Material sollte nativ in einem sterilen Röhrchen eingesandt werden. Geringe Mengen mit einem Abstrichtupfer aufnehmen, diesen in das Transportmedium (Abstrichtupfer mit Transport-Gel) verbringen.
Weitere Hinweise zu Entnahme, Versand, Untersuchungsmaterial und Bewertung:
Stuhl
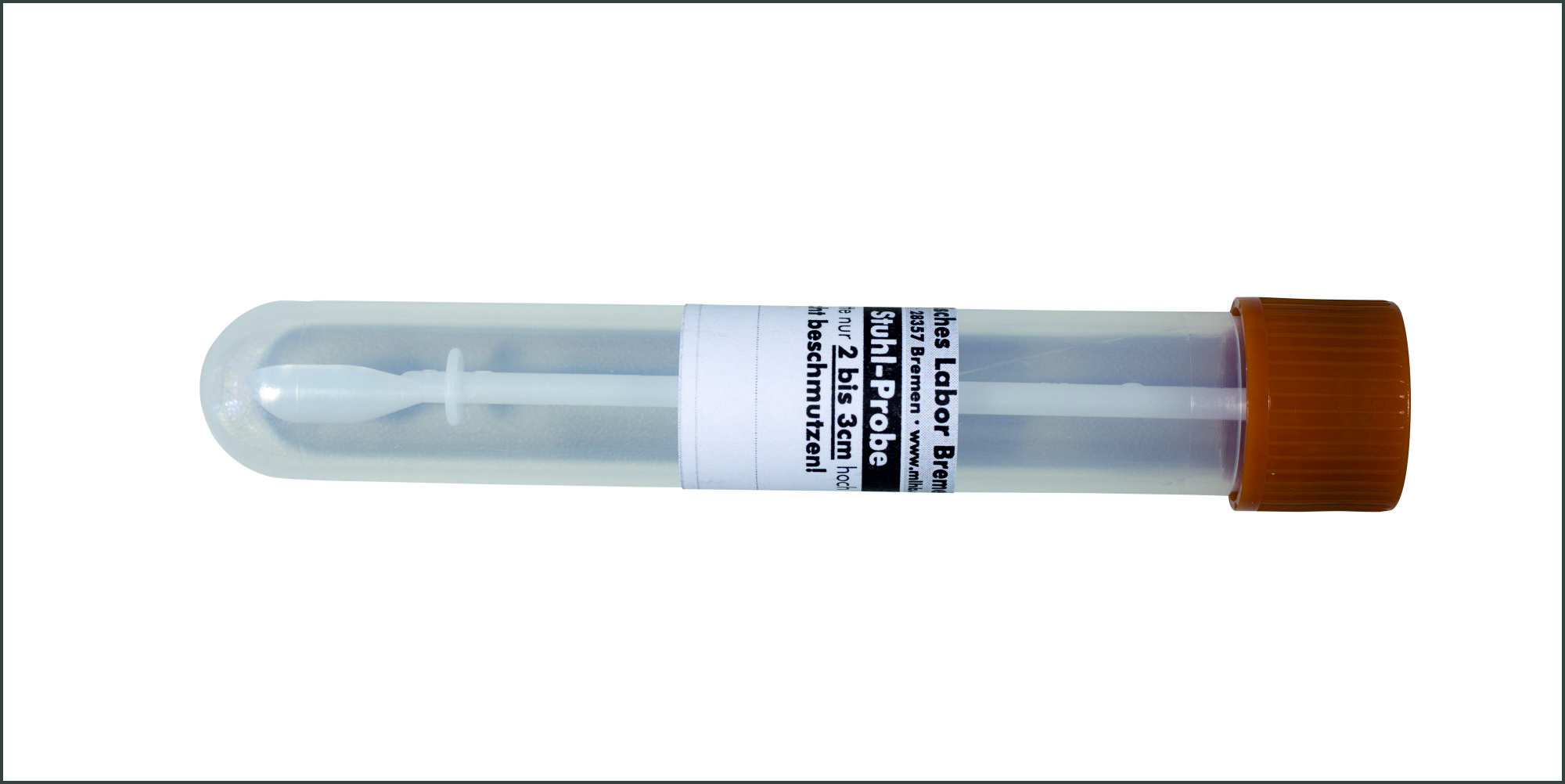
| Bezeichnung | Stuhl |
| Anwendungsgebiet |
Stuhlproben (ca. 1 Löffel pro Untersuchung) |
| Anforderung (Beispiel) |
E + R; evtl. Salmonellen, Shigellen, Yersinen, Campylobacter, Noro-Virus etc. |
Urin

| Bezeichnung | Urin-Monovette mit Stabilisator (Bakteriologische Untersuchung) |
| Anwendungsgebiet |
Mittelstrahlurin, Katheterurin |
| Anforderung (Beispiel) | E + R evtl. Sprosspilze |
Urin auf TBC, Blasenpunktionsurin
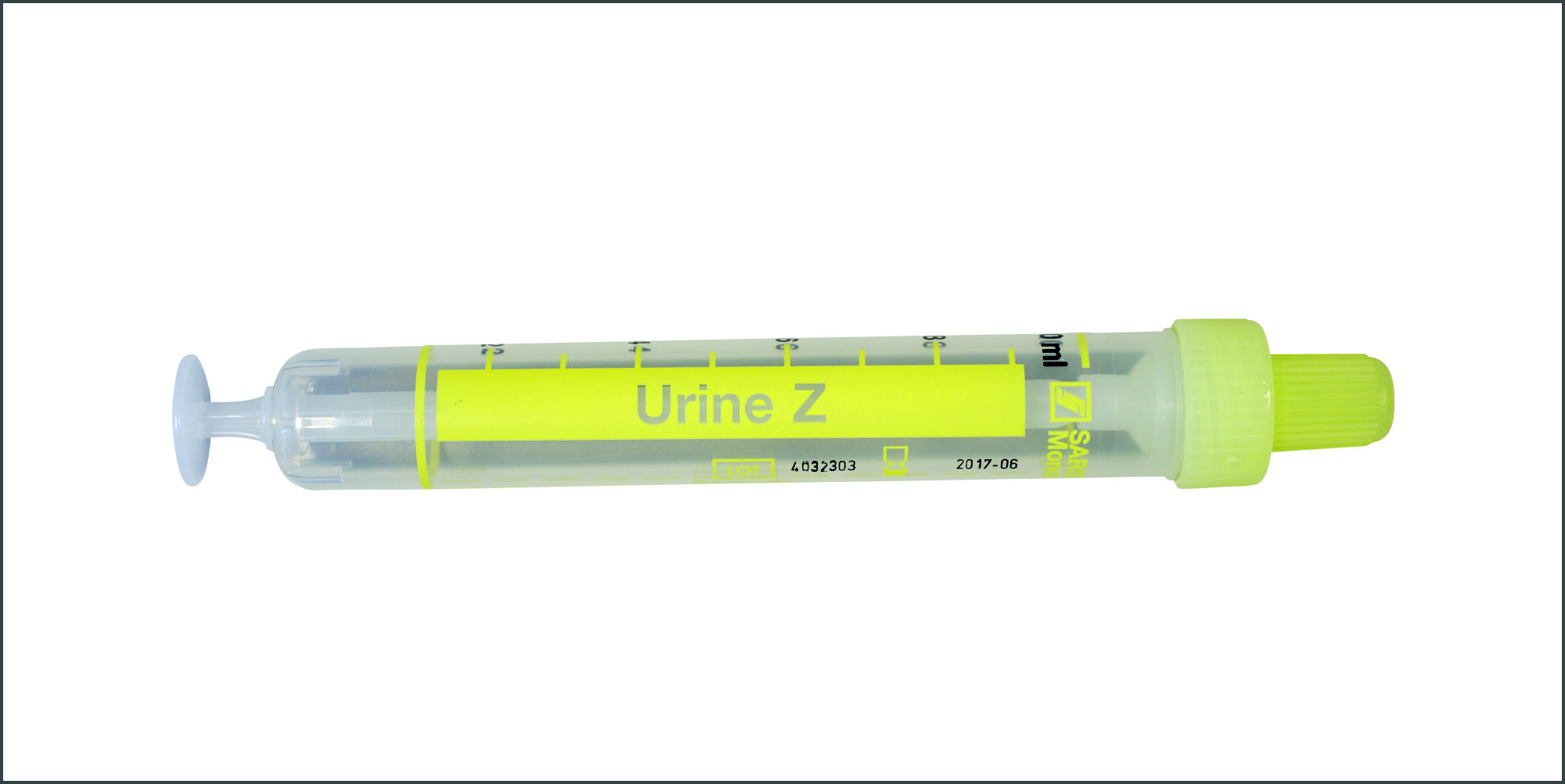
| Bezeichnung | Urin-Monovette ohne Stabilisator |
| Anwendungsgebiet |
TBC |
| Anforderung (Beispiel) |
BPU: E + R |
Bronchial- &Trachealsekret (1,2), Lavage (1), Sputum(1,2)

| Bezeichnung | Urin/Sputum (30mL) Sputum |
| Anwendungsgebiet |
Bronchial - & Trachealsekret |
| Anforderung (Beispiel) | E + R |
1 Lange Lager- und Transportzeiten müssen vermieden werden.
Hautschuppen, Nagel, Haare

| Bezeichnung | NICHT bei Schleimhäuten, Gewebeproben - Röhrchen, steril - Mikroprobengefäß, steril |
| Anwendungsgebiet |
Dermis |
| Anforderung (Beispiel) |
Dermatophyten |
Liquor (1), Punktat (1)
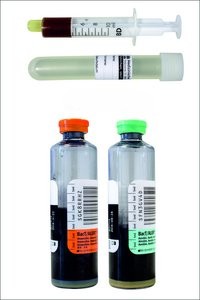
| Bezeichnung |
- Spritze Blutkulturflaschen aerob/anaerob (siehe Präanalytik) |
| Anforderung (Beispiel) |
E + R |
1 Lange Lager- und Transportzeiten müssen vermieden werden
Weitere Hinweise zu Entnahme, Versand, Untersuchungsmaterial und Bewertung von:
Eiter (2), Wundsekret (2) , Spülflüssigkeit
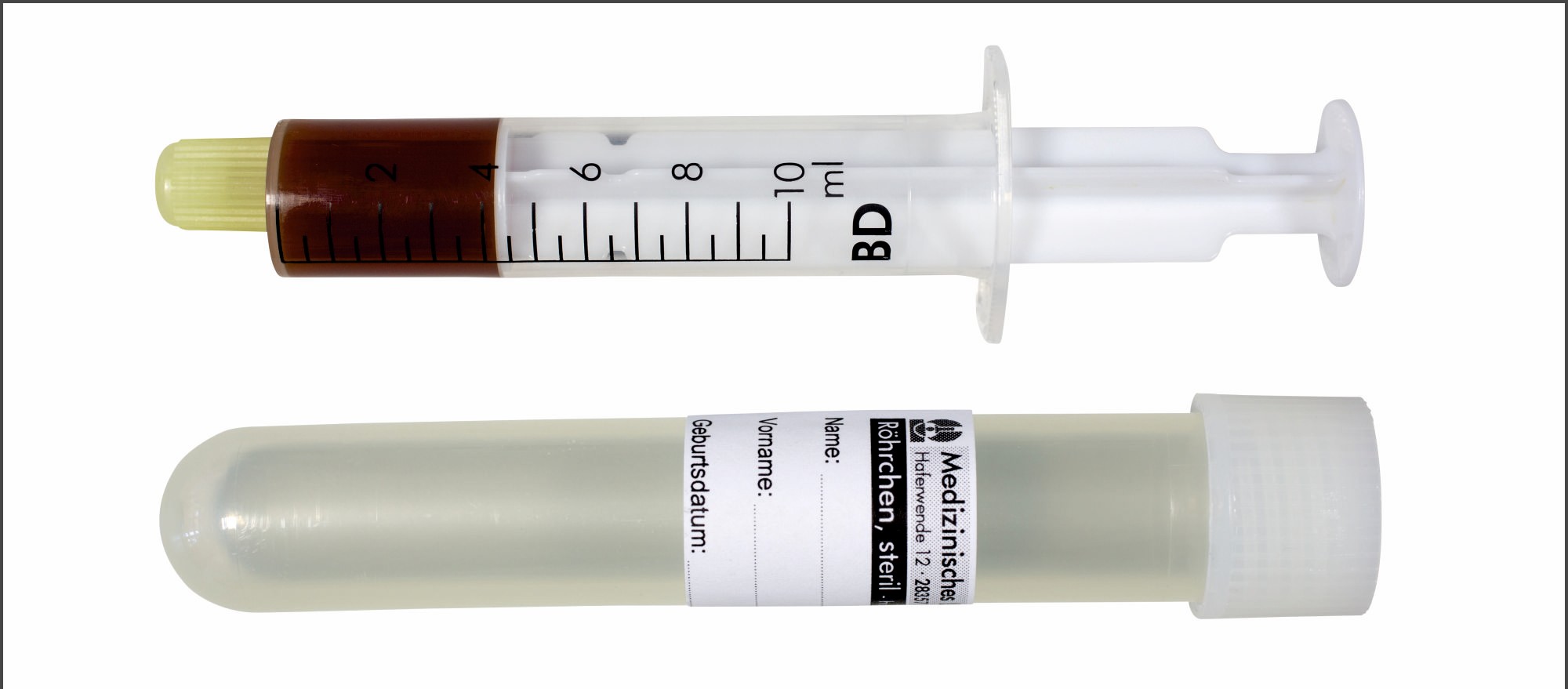
| Bezeichnung |
- Spritze |
| Anforderung (Beispiel) |
E + R |
2 Reichlich gewonnenes Material sollte nativ in einem sterilen Röhrchen eingesandt werden. Geringe Mengen mit einem Abstrichtupfer aufnehmen, diesen in das Transportmedium (Abstrichtupfer mit Transport-Gel) verbringen.
Blut

| Bezeichnung | Blutkulturflaschen - aerob - anaerob |
| Anforderung (Beispiel) |
E + R |
Biopsie-Material (3) Helicobacter pylori

| Bezeichnung | Portagerm pylori |
| Anwendungsgebiet |
Untersuchung von Biopsien aus Magen & Duodenum |
| Anforderung (Beispiel) |
Helicobacter pylori |
3 Kurze Verfallszeit, Transportmedium kurz vor Entnahmetermin anfordern

